2020年4月7日,浙江大学爱丁堡大学联合学院洪智课题组联合浙江大学基础医学院易聪课题组在《Frontiers in Cell and Developmental Biology》上发表题为“Mitochondrial Fusion Machinery Specifically Involved in Energy Deprivation-Induced Autophagy”的研究论文,阐明了线粒体形态与能量匮乏诱导自噬之间的关系。

文章大意
细胞自噬(Autophagy)是指细胞在面对内外环境改变时降解胞内物质进行再利用的过程。
根据其降解底物分为非选择性自噬和选择性自噬。非选择性自噬,也就是通常所讲的自噬,对降解底物没有选择性。选择性自噬则依赖于特异性自噬受体与LC3/Atg8互作降解受损的细胞器。大量研究表明,自噬在维持细胞稳态和生物有机体生长发育过程中发挥重要作用。细胞自噬功能异常与许多人类重大疾病如神经退行性疾病、II型糖尿病、脂肪肝、癌症等的发生发展密切相关。
线粒体作为细胞代谢和信号传导网络的中心调控细胞的能量合成、胞内钙稳态平衡、氧化磷酸化和细胞凋亡,是维持细胞正常生理功能最重要的细胞器之一。线粒体在不同细胞中的形态多样,并呈现动态变化,其融合和分裂的动态平衡影响线粒体的分布和形态,进而决定其生理功能。线粒体通过融合、分裂和微管化形成网络结构,对于维持生命体DNA的完整性以及线粒体遗传物质完整性具有很重要的作用。线粒体一旦发生损伤会迅速启动线粒体自噬,然而线粒体形态维持与巨自噬之间的联系仍然未知。
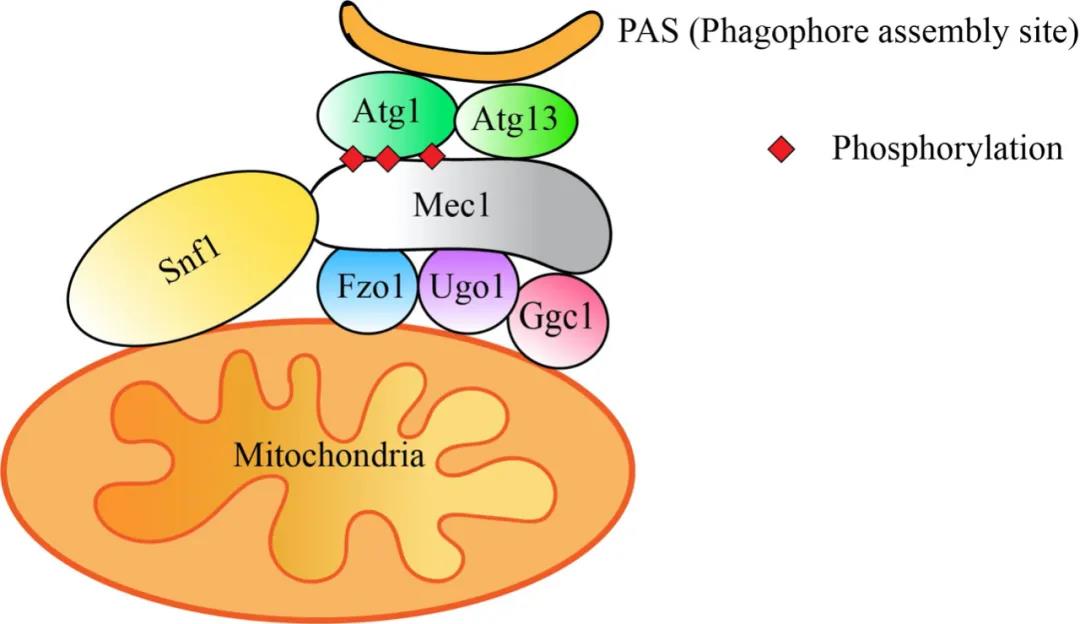
图:覃钰玲(洪智课题组博士生)
该研究发现在能量匮乏状态下,负责线粒体融合的分子机器Ugo1、Fzo1等,通过参与线粒体有氧呼吸调控Snf1(AMPK在酵母细胞中的同源物)和Mec1(ATR在酵母中的同源物)之间的互作。Ugo1、Fzo1等缺失导致Snf1活性下降,Mec1磷酸化水平降低,无法招募Atg1/ULK1和其它自噬蛋白至自噬前体上,最终抑制能量匮乏诱导自噬的发生。有趣的是,负责线粒体分裂和微管化的分子机器不参与能量匮乏诱导自噬。
吴酬飞副教授和姚伟静助理研究员为本文共同第一作者,易聪研究员和洪智研究员为本文的共同通讯作者。
课题获国家自然科学基金、科技部蛋白质机器重大研发计划等项目资助。
实验室介绍
洪智研究员课题组一直关注囊泡运输的时空调控、细胞器互作及稳态的系列研究,热衷于利用不同学科解答生物学问题,欢迎同样有志于科研、热爱冒险的你加入,一起玩转细胞生物学。
联系邮箱:zhihong@intl.zju.edu.cn
浙大教师主页:https://person.zju.edu.cn/hongzhi
(转自ZJE官网)





