
评价细胞的再生功能,是一个重要的科学问题。细胞在损伤和疾病中的“可塑性”,直接影响了组织再生的能力。细胞适应外界环境刺激的能力 各不相同。在组织再生中,只有“能屈能伸”的细胞,在承受外界异常刺激后,可以通过自我更新、增殖、分化等过程,发挥“救援”作用。
软骨是人类关节表面一层薄薄的结缔组织,为关节运动提供支撑、缓冲、和润滑功能。随着物种演化,成年人类关节软骨的自我修复能力已经丧失;骨关节炎(osteoarthritis)等致残性疾病,影响终生。总之,软骨细胞对抗恶劣环境的尝试以失败而告终。
软骨细胞在功能丧失前,经历了什么?这些细胞是否还有再生潜力?我们又该如何准确评价它们的质量?
近日,浙江大学欧阳宏伟团队以题为A High-Resolution Route Map Reveals Distinct Stages of Chondrocyte Dedifferentiation for Cartilage Regeneration在Bone Research发文,揭示了软骨细胞丧失功能前的多个分子细节,绘制出细胞表型变化“双相模型”的高清图谱;基于该模型,独创出软骨细胞再生可塑性的评估体系。
▲行业挑战
成年人软骨没有自愈能力,损伤之后,极易发生骨关节炎等不可逆性病变,导致整个关节失去活动能力。据不完全统计,中国有上亿的骨关节炎患者,大多患者老年人。可以说,关节软骨的健康是体面生存的一道重要指标。
为何要针对软骨细胞开展研究呢?它们只占关节软骨组织的不到5%,但是却能分泌大量的细胞外基质(Extracellular Matrix,ECM)成分。这些ECM直接为软骨的力学功能提供了物质基础。所以,软骨细胞虽少,功能却很重要。
有一种再生医学的治疗理念,就是要为软骨组织补充细胞。比如,可以从患者关节非承重部位获取软骨细胞,进行数量上的扩增,并重新植入关节。这项技术叫做“自体软骨细胞移植“。欧阳宏伟教授曾经开展的临床试验,也证明了这项技术,可以在软骨损伤恶化至终末期之前,帮助恢复关节功能。
但是,细胞移植前的一个重要挑战,就是对软骨细胞的质量进行控制。软骨细胞“去分化”(chondrocyte dedifferentiation)极易发生。简言之就是已经分化成熟的软骨细胞,在受到外界刺激的情况下,失去自己的成熟功能表型,转变为一种”无用“的纤维软骨细胞。这种外界刺激,最常见是,软骨细胞被从体内环境取出,放入体外环境进行培养和扩增。它最早被报道于1972年,但多年来却鲜有人给与完整和清晰的解释。软骨细胞去分化过程中伴随着复杂的分子机制及变化规律。虽然从离体初始细胞失去功能表型,但仍可在适宜条件刺激下(如三维培养)恢复功能;但是当去分化持续的时间过长,软骨细胞将没有这种恢复的潜能。
在该研究中,欧阳宏伟教授团队通过单细胞转录组测序、活细胞代谢检测、ATAC测序等多重手段,建立了一个多时间点软骨细胞去分化的高清细胞表型图谱;原创性定义了软骨细胞去分化的存在不同时期,并进一步阐释这个现象背后的生物学事件;为临床细胞移植鉴定软骨细胞质量,提供更多可靠的标志物。
▲软骨细胞去分化:从挣扎到失控
软骨细胞去分化至少经历两个时期,是“双相模型”中的理论核心(图1)。去分化早期的细胞,还具有恢复功能的能力;去分化晚期的细胞“彻底没救了”。虽然这个现象大家都熟知,但却没有搞清这背后的缘由,以及如何快速鉴定细胞处于什么状态。
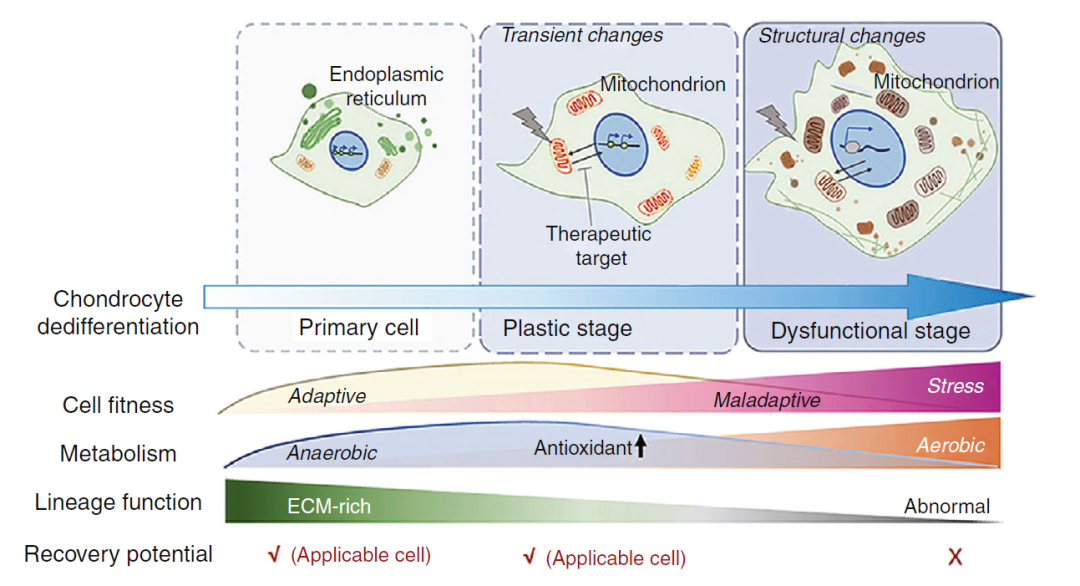
图1:软骨细胞去分化的不同状态
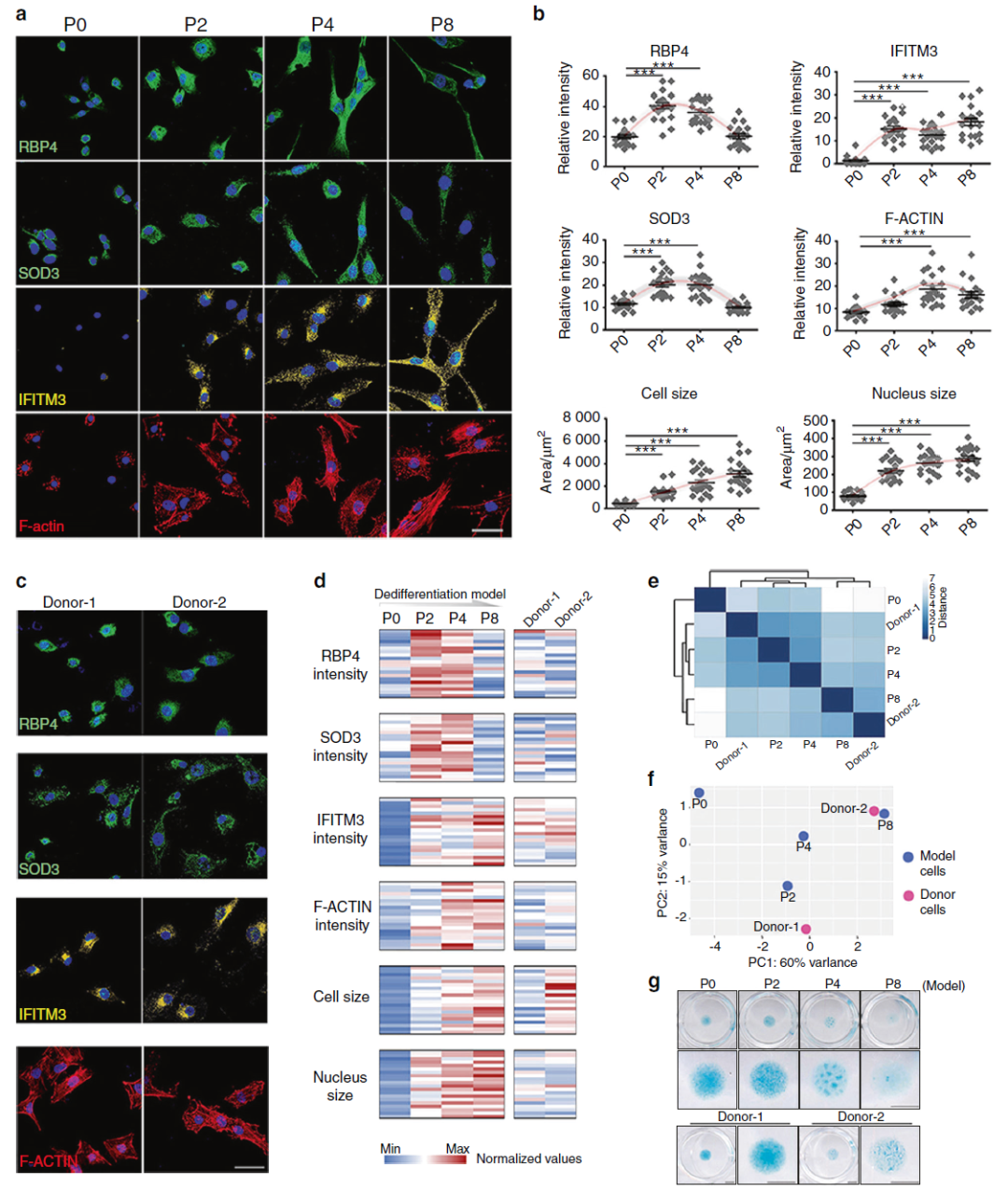
研究团队首先利用单细胞转录组测序,鉴定出小鼠软骨细胞去分化的细胞亚群。比起传统手段,单细胞测序能够提供更清晰的“指导”:去分化早期的软骨细胞中含有一个独特的细胞亚群(代谢性亚群,Metabolic Cluster,MetC)(图2)。这个亚群同时高表达无氧糖酵解和氧化应激相关的基因,虽然它占比不多(35.1%左右),但却为进一步研究提供了重要线索。
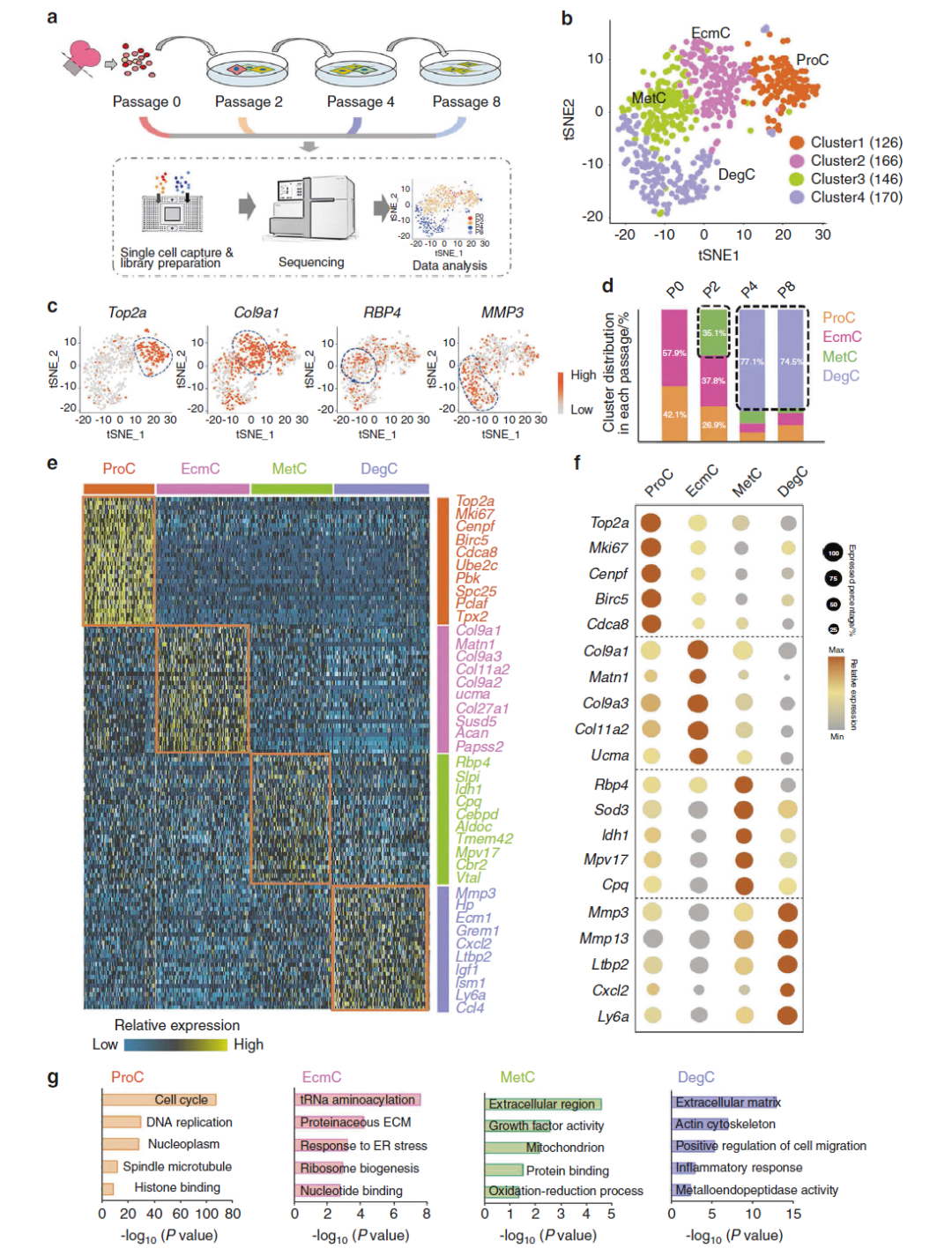
图2:单细胞转录组测序揭示软骨细胞去分化过程的不同细胞亚群
随后,他们发现,去分化过程存在一个代谢模式的转变。早期的细胞,无氧呼吸和有氧呼吸的基础值都比原代软骨细胞(初始状态)更高;而晚期细胞趋于能产生更多能量的有氧呼吸模式(图3)。(注:体内生理状态的软骨细胞采用无氧呼吸)
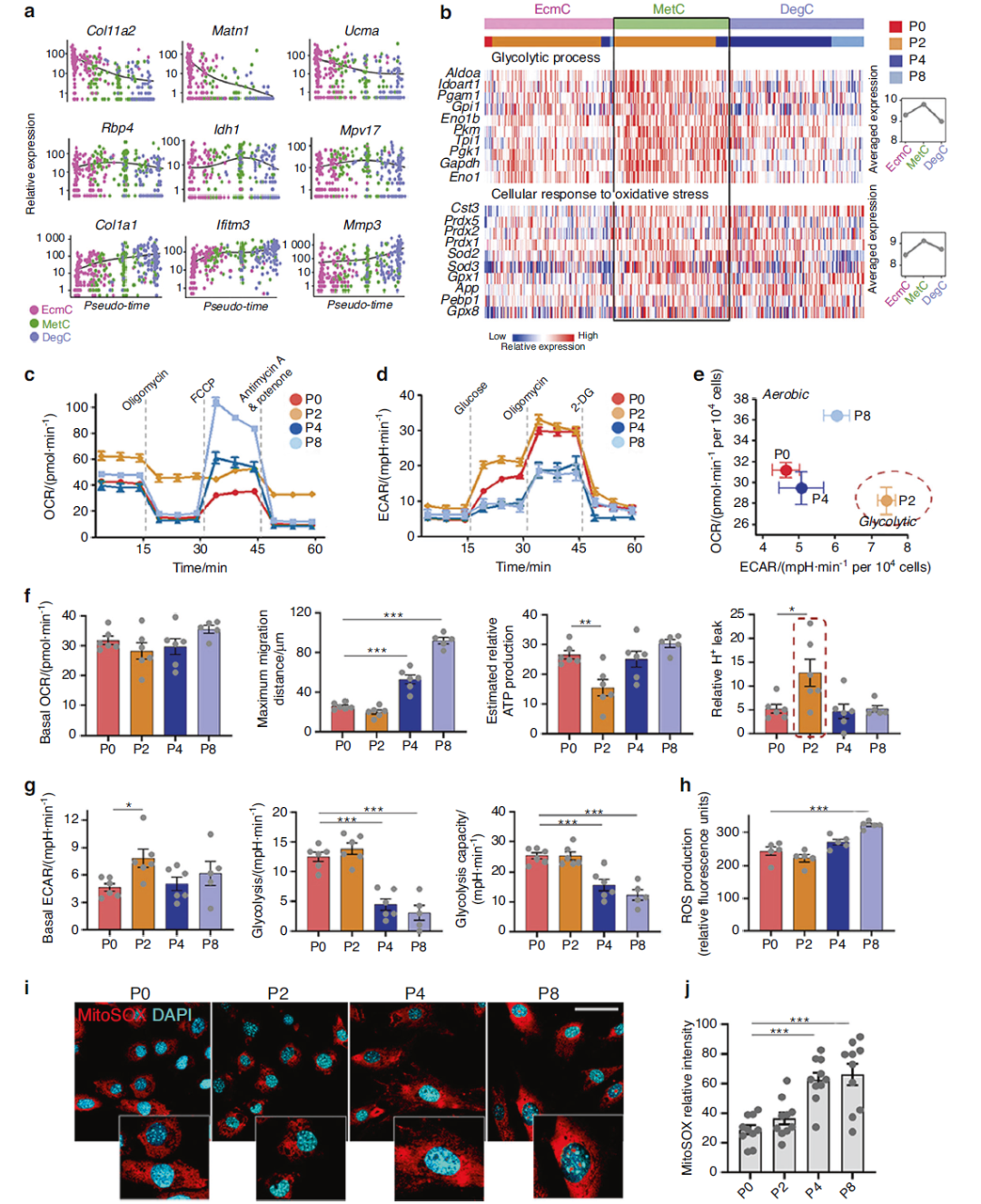
图3:软骨细胞去分化伴随代谢状态的改变
不仅呼吸模式改变,细胞精微结构也发生了改变。随着去分化发生,细胞内的线粒体数量增多,至晚期发生结构破坏;ATAC-seq揭示,去分化晚期的细胞染色质趋于关闭状态(细胞已经“拒绝”了继续分泌组织需要的胞外基质),但少数应对氧化刺激的区域开放(“续命”的功能需要保留)(图4)。(注:ATAC-seq利用转座子切割在特定时空开放的核染色质区,进而在特定时空获得基因组中所有活跃转录的调控序列,是Assay for transposase-accessible chromatin with high-throughput sequencing的首字母缩写)
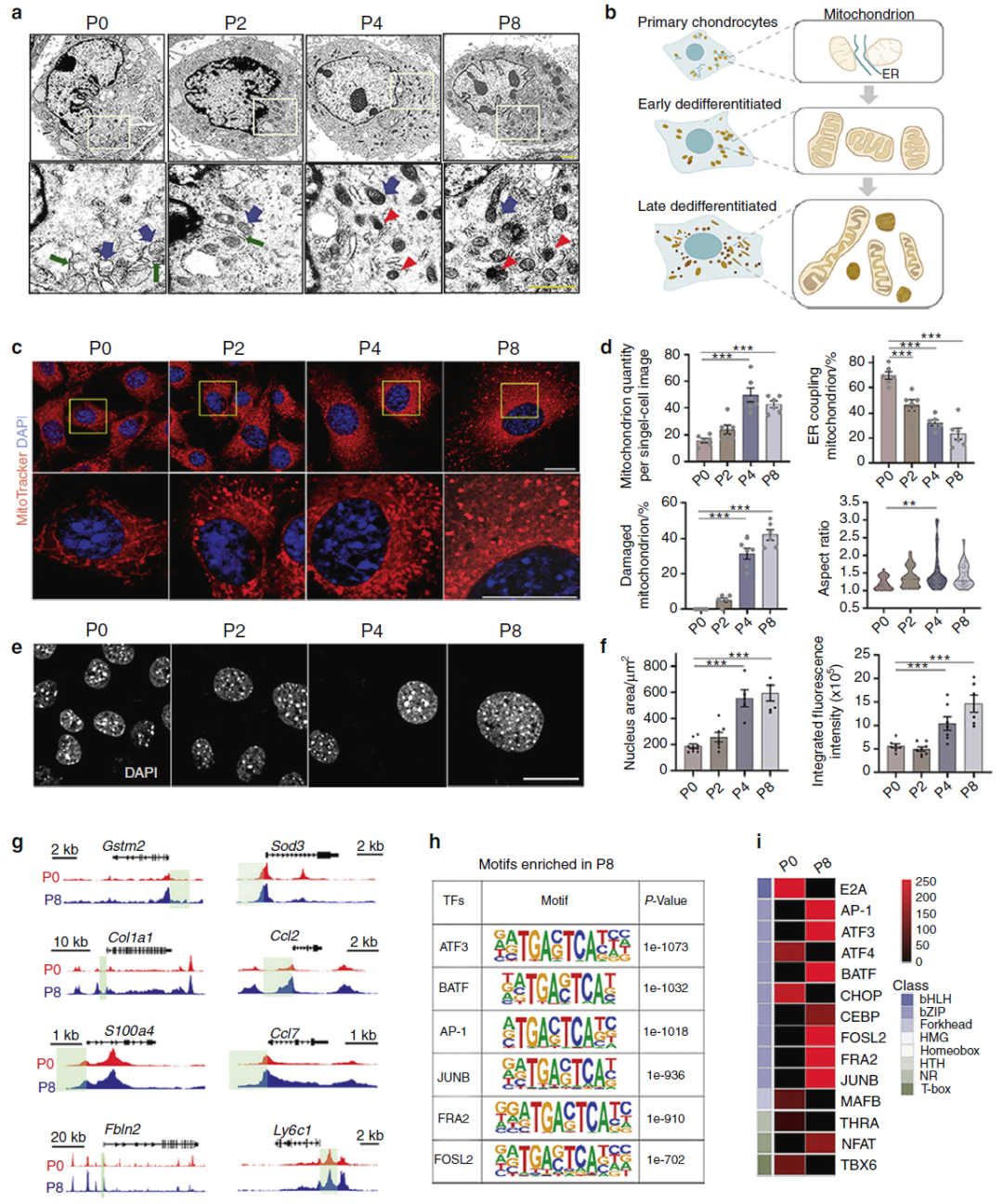
图4:去分化晚期的细胞具有亚细胞结构的损伤及染色质应激性重塑
在细胞功能层面,利用阻断线粒体氧化应激信号传导的小分子抑制剂BTB06584,早期去分化的软骨细胞的功能丧失可以有效缓解;然而晚期去分化的表型只能部分挽救。
最终,研究团队发现,软骨细胞去分化的实质,其实更接近于“病理性增生”(hypertrophy)的概念:一种基于应激下的代偿性增生,但是不伴随细胞种类的改变。
软骨细胞去分化早期,为了适应环境改变,“使出浑身解数”,通过增强无氧呼吸,来代偿有氧环境产生的异常刺激,分泌胞外基质的任务暂且关闭;如果短暂时间内,这种恶劣环境(力学和氧分压等)可以缓解,软骨功能又能“重回巅峰”。但是随着适应力的耗竭,细胞微结构的损伤,软骨细胞逐渐走向不可逆性失功能,只留下维持生命的元件还在运行,直至死亡。
▲终极目标
软骨细胞去分化并仅仅是一个科学问题,它影响着软骨细胞移植的临床应用。在细胞大规模扩增中,人们需要想尽各种办法与之抗争,维持软骨细胞的表型。但是,临床实际能获得的细胞质量参差不齐,如何知道扩增后的细胞是“好”是“坏”,实现良好的质控?
研究团队想要开发一个基于软骨细胞去分化不同时期特征的评估体系,即用发现的去分化早期和晚期标志物,快速鉴定细胞是否具有表型恢复的潜能。
在研究的最后,作者将小鼠软骨细胞去分化“双相模型”中发现的标志物,在人类的软骨细胞去分化中得以验证;并通过一种方便快捷的方式反向预测出,不同人类个体来源的软骨细胞是处于去分化早期,还是晚期(图5)。他们发现,目前的系统可以粗略评估出一种细胞是“好”或者“不好”。但是因为人类细胞,特别是骨关节炎患者的组织本来存在很大异质性,想要进一步精准定位细胞的状态,整个评估体系还有升级迭代的空间。
综上,该研究的意义在于,为软骨细胞去分化提供分子层面的科学解释,不仅解析了软骨细胞体外扩增去分化这一生物现象,未来也有望为定义软骨细胞的各种状态、药物筛选和评估重编程细胞的再生潜能等提供理论支持。但愿,在不久的将来,人类软骨细胞的功能表型可以被精准地评估和操控;软骨细胞的再生能力也能够有所提升;关节功能得以恢复,才能实现60岁以后的体面人生。
该研究的通讯作者为浙江大学欧阳宏伟教授。第一作者为浙江大学爱丁堡大学联合学院(ZJE)博士后陈奕姗,共同第一作者为浙江大学医学院2015级本科生余也可和浙江大学医学院2018级博士生文雅。该研究得到了国家重点研发计划(2017TFA0104900),国家自然科学基金(T2121004等)的资助。
文章链接:https://www.nature.com/articles/s41413-022-00209-w
![]()
课题组介绍
欧阳宏伟教授,作为课题组长期从事干细胞与骨、软骨、肌腱组织的再生研究,突破了骨软骨组织自愈能力低下的难题,发明了“骨软骨原位修复与再生技术”,建立和实践了组织工程要素的三条临床转化途径,即自体细胞/因子浓集治疗技术、支架材料器械产品和细胞材料复合移植技术。
课题组网页:http://person.zju.edu.cn/en/ouyanghongwei;招聘主观能动性强的博后。
陈奕姗博士毕业于浙江大学医学院干细胞与再生医学专业。2020年1月加入ZJE从事博士后研究,导师为欧阳宏伟教授。主要研究方向为软骨细胞再生可塑性的高清解析,及功能表型的精准调控
(图文:课题组提供,图文编辑:黄晓涵 梁爽 孙晓蕾 ,责任编辑:李亦楠)





