蝙蝠:飞行、免疫与病毒耐受的进化奇迹。
蝙蝠是唯一能够进行主动飞行的哺乳动物。为了适应飞行带来的高代谢压力,它们进化出了独特的应激耐受机制。这种机制与蝙蝠对病毒的天然耐受性密切相关,因为许多应激副产物与病毒的病原体相关分子模式(PAMPs)相似。蝙蝠对埃博拉、SARS等致命病毒表现出显著的耐受性,但不同蝙蝠物种之间的耐受机制及其差异仍有待深入研究。

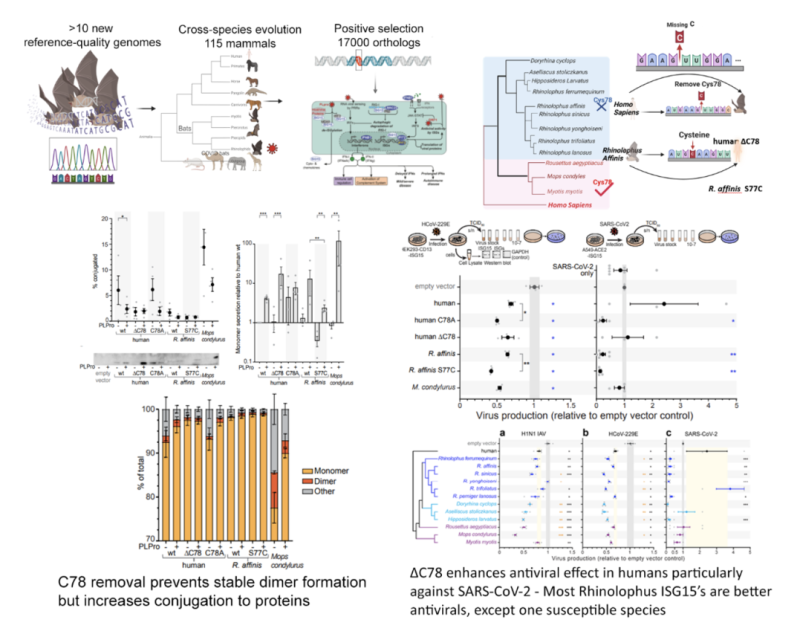
随着COVID-19疫情的爆发,我们对12种蝙蝠物种进行了基因组测序,并生成参考级高质量长度长基因组,其中包括SARS相关病毒的宿主——中国菊头蝠。通过对115种哺乳动物的跨物种比较分析, 以及基于对17,000个直系同源基因的分析,我们发现蝙蝠的“免疫系统过程”具有独特的进化特征,且在系统发育树的不同分支中表现出不同的选择压力。
研究进一步揭示了中国菊头蝠中与病毒感染、宿主细胞入侵、先天免疫调控、补体激活及免疫细胞信号传导相关的基因受到正向选择。其中一个关键基因是ISG15,它在菊头蝠和叶口蝠(SARS相关病毒的宿主)中表现出独特的半胱氨酸缺失。在人类中,这一位点(Cys78)形成二硫键,稳定ISG15二聚体以促进分泌,并因此与驱动人体内过度炎症反应相关。
实验验证表明,蝙蝠ISG15在细胞内具有更强的抗病毒效能,且表现出病毒和物种特异性差异。例如,蝙蝠ISG15对甲型流感病毒的抗病毒能力与人类相似,但对冠状病毒(包括SARS-CoV-2)的抗病毒效果显著增强。人类ISG15易被SARS-CoV-2的PLPro酶切割,从而削弱其抗病毒能力;而菊头蝠ISG15(除一个物种外)能够抵抗PLPro酶的切割,有效抑制SARS-CoV-2的复制。
ISG15的功能类似于泛素,通过与其他蛋白质结合(ISG化)调控细胞反应。研究发现,病毒存在时,蝙蝠ISG15的细胞内ISG化作用显著增强。这可能是菊头蝠和叶口蝠能够启动高效抗病毒反应而不引发过度炎症的关键因素之一。
这项研究不仅揭示了蝙蝠免疫系统的独特进化机制,还强调了多物种参考基因组在免疫功能研究中的重要性。即使在亲缘关系密切的蝙蝠物种中,我们也发现了显著的物种特异性表型。未来,这些发现将为进一步探索人类免疫调控提供重要线索。
作者简介
本研究的第一作者为爱丁堡大学(海宁)博士生董越。浙江大学爱丁堡大学联合学院(ZJE)博士生李筱萌,本科生陆平和杨一欣共同参与研究。本研究共同通讯作者为ZJE研究员Aaron Irving,德国法兰克福森肯贝格研究所的Michael Hiller。
原文链接:https://www.nature.com/articles/s41586-024-08471-0DOI 10.1038/s41586-024-08471-0

课题组介绍
Aaron Irving的团队专注于比较免疫学和新型人畜共患病,利用了蝙蝠等病毒宿主物种的进化基因组学,提供了表征病原体的健康免疫反应的平台。已以通讯作者身份在Cell、Nature、Nature Microbiology、PNAS和Trends in Immunology等出版物上发表了46篇研究论文。获得国家自然科学基金会(RFIS-II)的 “杰出外国青年科学家” 以及 “浙江省国家自然科学委员会青年人才” 称号。领导了浙江省自然科学基金重点项目,且是英国生物技术与生物科学研究委员会(BBSRC)项目的合作者,Bat1K联盟的地区主席,15家期刊的客座主编或副主编,多个病毒学和免疫学学会的成员,英国创新与研究中心、欧洲研究委员会、德国癌症研究中心的基金审稿人,以及英国爱丁堡大学的名誉讲师。
课题组简介:https://person.zju.edu.cn/aaronirving
(转载自微信公众号浙江大学爱丁堡大学联合学院《我院“蝙蝠侠”Aaron研究成果登<自然>!揭示蝙蝠的进化奇迹》;图文编辑:李亦楠、李嵩皎;责任编辑:张旖;审核:杨祎;终审:瞿海东)





