作者简介
本系列研究的第一作者为浙江大学爱丁堡大学联合学院博士后王小召博士,共同第一作者为浙江大学爱丁堡大学联合学院博士后林俊鑫博士、本科生吴沁等,欧阳宏伟教授为论文通讯作者,研究得到了国家自然科学基金委创新群体项目(T2121004)等的资助。该系列研究获评国际校区2022年学术成果奖。
王小召博士毕业于浙江大学材料科学与工程学院,博士后研究方向为人体运动系统复杂结构的高清解析及精准再生。

科研成果介绍
浙江大学欧阳宏伟教授团队以“Stage-specific and location-specific cartilage calcification in osteoarthritis development”为题在Annals of the Rheumatic Diseases上发文,首次从物质分子组装、微纳结构及微观力学等多学科角度探索骨关节炎(OA)发展中“自上而下”和“自下而上”的双向软骨钙化病理机制,发现“自上而下”钙化是从关节面开始的渐变式钙化,“自下而上”钙化是从骨软骨交界处发生的跳跃式钙化并形成“骨-软骨-钙化软骨”的三明治特征结构。这项研究是本团队继第一篇揭示正常人体关节骨软骨界面组织后(Nano Letters,2022),第一篇揭示人体关节软骨病理钙化的物质科学机制。人体膝关节的“骨-软骨”界面组织,结构成分复杂,受力严酷。正常的骨软骨界面组织可维持软骨-硬骨不同材料之间的抗疲劳粘附,还能保证人体每年几百万次力学加载中的有效力学传导,其背后的材料学机制至关重要。浙江大学欧阳宏伟教授团队从结构组装决定力学功能的角度出发,利用多种高分辨材料学表征手段,发现骨软骨界面组织存在一层特殊的20-30 μm的超薄过渡区(图1),其精致的有机-无机成分组装、微纳结构转变及指数级模量增长为界面的优异力学传导功能提供保证(Nano Lett. 2022, 22, 2309-2319)。
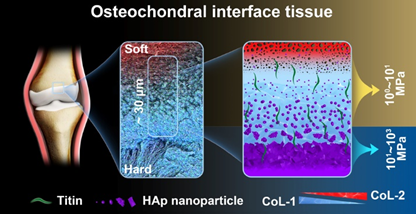
图1 “骨-软骨”界面组织示意图
骨软骨界面的超微结构组装一旦发生改变,很容易引发骨关节炎(OA)。目前,OA病理过程中软骨降解及软骨下骨重塑被广泛研究。然而,二者的界面-骨软骨界面组织的超微结构、分子组装及力学在OA发展过程中的病理变化却知之甚少。因此,本团队以正常人骨软骨界面结构为参照,研究了不同OA阶段骨软骨界面组织“自下而上”的病理性钙化侵袭软骨的过程及机制(图2)。研究发现,在OA早期,即出现了始于钙化软骨处的特征性三明治钙化结构的“自下而上”病理性钙化,潮线附近的酸性物质及肥大软骨细胞促进这一特征结构形成。随着OA的发展,钙化软骨处的三明治钙化结构融合,钙化软骨区域增厚,向上层软骨入侵。与正常样本相比,界面组织的超微结构及成分组装在OA早期即发生巨大转变,致密组装结构的HAp晶体失去纳米级梯度组装,晶体结晶性增加,组织力学显著提高。而OA晚期则呈现完全相反的趋势。这种差异可能归因于钙化软骨处由肥大软骨细胞调控的不同晶体成核方式,OA早期为基质囊泡成核,OA晚期为碳酸盐成核。
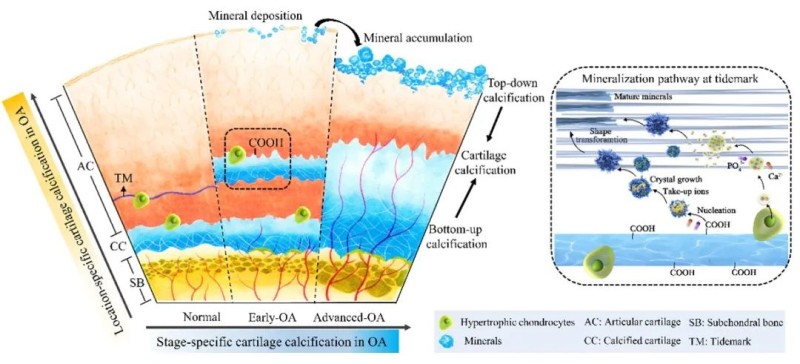
图2 人类膝关节OA进展过程中自上而下和自下而上的双向软骨钙化过程及机制
OA早期,缺乏纳米级异质组装的HAp会引起骨软骨界面的局部应力集中,导致微裂纹形成(OA早期事件)。微裂纹会加速软骨和下骨的串扰,破坏软骨稳态,加速OA进展。OA早期骨软骨界面组织力学的增加会降低软骨下骨的机械载荷,进而激活破骨细胞的骨吸收,而OA晚期界面力学下降会导致软骨下骨承担更高的机械载荷而激活成骨细胞,促进下骨的骨形成。通过骨软骨界面组织的结构组装和微观力学解析,可以从材料学角度进一步解释软骨下骨在OA早期的骨丢失和OA晚期的骨重塑现象。除了骨软骨界面组织,本研究还探索了OA中始于关节软骨层的“自上而下”的软骨病理性钙化过程。在OA早期出现的“自上而下”钙化,始于软骨表面损伤处及纤维化区域,并形成球形纳米颗粒;在晚期OA软骨中矿物质为纤维及致密组装结构(HAp),并进一步侵入深层软骨。软骨细胞外基质微环境的改变及周围软骨细胞肥大化进一步促进了纳米矿物质的合成。基于OA发展过程中的双向软骨钙化机制,未来可以开发预防病理性钙化的针对性疗法。对于关节表面“自上而下”的钙化,可以开发通过抑制软骨细胞的转分化和降低滑液中Ca2+和PO43-离子浓度来防止晶体的早期形成及生长。对于钙化软骨处“自下而上”的软骨钙化,需要设计调控细胞代谢活动的治疗策略。
本研究从物质科学角度完善了目前对OA病理发展机制的理解,探索了人体膝关节OA发展过程中具有位置和阶段特异性的双向软骨钙化病理特征,探讨了其对OA发展的病理作用,为潜在的治疗靶向策略提供新方向。
作者说
本研究属于医学、生命科学、材料科学及力学等多领域的交叉。我们集成了多尺度多模态的检测手段,探索了人体正常膝关节骨软骨界面的超微结构组装及力学传导机制。整个研究过程非常依赖于先进技术,我们走过了上海中科院的同步辐射线站、清华大学的冷冻电镜平台、西湖大学的质谱平台及浙大的多个表征平台,与多位不同领域的专家讨论合作,文章经历了超过2年的审稿-修稿,反复经历过大修-小修-拒稿等过程,并最终于2022年3月3日在Nano Letters上发表。
进一步,我们很好奇在OA病理下骨软骨界面的精致组装及力学功能会发生怎么的变化。我们收集了超过50例的人体膝关节置换的样本,从结构、成分及力学的角度阐明骨软骨界面的变化对OA病理发展的影响。我们发现在OA早期和OA晚期,骨软骨界面处的矿物质组装及力学呈现了完全相反的趋势,进一步分析我们发现其差异的根源在于HAp合成组装的不同路径及其肥大软骨细胞调控的不同成核机理。在研究工程中,我们收集了超过5000张电镜图片,统计并观察了OA病理软骨的结构转变过程,并意外发现了在非常早期的OA浅层软骨处存在珍珠样纳米HAp球体,并随着OA的进展转变为致密组装态,向下层软骨入侵,因而提出了双向软骨钙化加速OA进展的概念。同时,我们与ZJUI的胡欢教授合作,利用他们的原子力显微镜(AFM)表征组织的米力学特性,体现了校区非常好的医工交叉合作。本研究从投稿到接收经历约半年时间,并于2022年10月19日在Annals of the Rheumatic Diseases上发表。
经验:1.科学研究充满诸多不确定性,在实验之前我们也不确定结果是什么,但这些未知的结果才真正值得探索;2.科学研究是有偏见的,但逐渐突破并完善自我,一定会被欣赏和尊重。
学术成果奖

国际校区于每年年底评选出本年度最值得表彰的学术成果,2022年度共评选出本系列研究等10项研究成果,科学101栏目将陆续介绍部分获奖成果。
(图文:王小召,编辑整理:张梦雪,责任编辑:李亦楠)





